Лекция № 8. Закономерности управления сложными процессами
Сложными называются процессы, в которых наряду с реакцией, приводящей к образованию целевого продукта (целевой реакцией), протекают побочные реакции.
Характеристика модели:
1. Выход целевого продукта не равен конверсии реагента β ≠ α;
2. Выход целевого продукта, даже теоретически не может достигнуть значения 100% β < 100%.
Объекты управления:
Наряду со скоростью процесса, положением равновесия (если реакция обратима) объектом управления в сложных процессах становится селективность.
r = f (С, р, t, kat) или r = f (W, ω, f) в зависимости от лимитирующей стадии
α* = f (C, p, t)
S = f (C, p, t, kat)
Инструменты управления: кинетические параметры.
Рассмотрим, как влияют основные технологические параметры на скорость и селективность сложного необратимого гомогенного процесса.
Пусть протекают две параллельные реакции, в которых расходуется реагент А. 
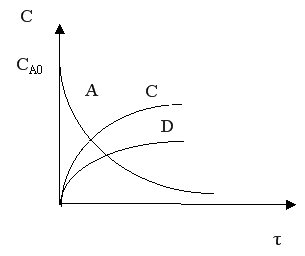
Кинетические кривые для сложно-параллельного процесса имеют вид, представленный на рисунке. Концентрация исходного реагента А уменьшается во времени, а концентрация продуктов C и D увеличивается, причем скорость увеличения зависит от порядка реакции. При n1 > n2 быстрее увеличивается концентрация целевого продукта.
Для анализа воспользуемся понятием дифференциальной селективности, под которой понимают отношение скорости целевой реакции (скорости образования целевого продукта) к общей скорости процесса (скорости расходования реагента).
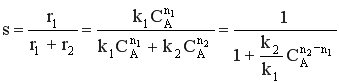
При условии, что 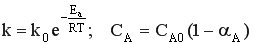
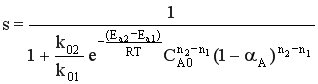
Используя полученную формулу, проведем анализ влияния начальной концентрация реагента, степени его превращения, давления и температуры на селективность процесса.
Характер влияния концентрации, давления и конверсии зависит от соотношения порядков целевой и побочной реакции.
Если порядки равны, начальная концентрация, давление и конверсия не влияют на селективность процесса. Если порядок целевой реакции выше, селективность увеличивается при повышении концентрации реагента и давления и уменьшается при достижении высоких конверсий. Если порядок целевой реакции ниже, чем порядок побочной реакции, при увеличении концентрации реагента и давления селективность должна понижаться, а увеличение времени реакции (конверсии реагента) приводит к повышению селективности.
При СА0 ↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
При αА↑ rхим. р.↓ если n1 = n2 s = const
если n1 > n2 s↓
если n1 < n2 s↑
Для газофазных реакций
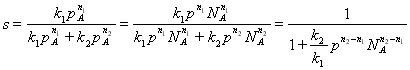
При р↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
Влияние температуры зависит от соотношения энергий активации целевой и побочной реакции.
При t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const
если Еа1 > Еа2 s↑
если Еа1 < Еа2 s↓
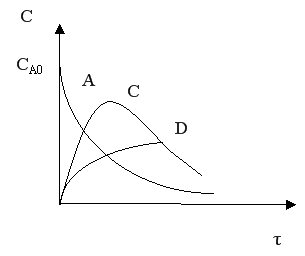
Рассмотрим другой тип сложных процессов – сложно-последовательный необратимый гомогенный процесс (консекутивный).
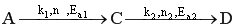
С течением времени концентрация реагента А снижается. Концентрация промежуточного продукта С вначале увеличивается, достигает своего максимального значения, затем убывает. Концентрация продукта D увеличивается по мере протекания реакции. Величина максимальной концентрации продукта С зависит от соотношения скоростей каждой из последовательных стадий.
Если целевым продуктом является продукт С, то селективность процесса равна
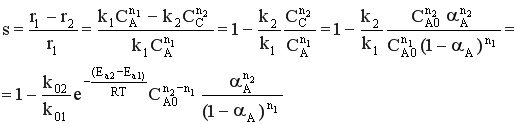
При увеличении начальной концентрации реагента
СА0 ↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
При увеличении степени превращения реагента
αА↑ rхим. р , s↓
При увеличении температуры
t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const
если Еа1 > Еа2 s↑
если Еа1 < Еа2 s↓
На селективность газофазных процессов будет оказывать влияние давление.
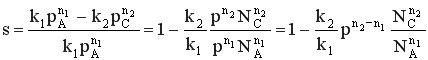
При р↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
Анализ показал, что в некоторых случаях изменение технологического параметра может привести к увеличению скорости процесса, а селективность при этом уменьшится или к увеличению селективности при снижении скорости процесса. Выбор оптимального значения этого технологического параметра производится путем технологических и экономических расчетов. Очень часто предпочитают получить высокую селективность, особенно если сырье имеет высокую стоимость, высока стоимость отделения и очистки целевого продукта от побочных продуктов, а скорость процесса невелика.
Обобщая вышесказанное, можно сделать следующие выводы:
-
При разработке технологии сложных процессов основное внимание следует уделить селективности процесса. Другими словами, нужно найти условия, обеспечивающие преимущественное протекание целевой реакции.
-
Условия проведения процесса определяются на основании экспериментального изучения кинетики процесса (определения порядка всех реакций, энергии активации и др.). Найденные условия можно менять в узком диапазоне.
-
Самое лучшее решение в задаче повышения селективности процесса – это нахождение селективного катализатора.
Пример Получение азотной кислоты. Стадия окисления аммиака
Азотная кислота является одним из важнейших многотоннажных продуктов химической промышленности. Процесс ее производства складывается из трех стадий:
-
окисление аммиака с целью получения оксида азота (II)
4NH3 + 5O2 → 4NО + 6H2O;
2) окисление NO до NO2 2NO + O2 ↔ 2NO2;
3) абсорбция оксидов азота водой 4NO2 + O2 + 2H2O → 4HNO3 .
Для выбора инструментов управления первой стадией процесса дадим технологическую классификацию процесса: процесс сложный, необратимый, экзотермический, каталитический, гомофазный, но гетерогенный.
При сгорании аммиака в отсутствии катализатора образуются азот и вода. 4NH3 + 3O2 → 2N2 + 6H2O + 1268 кДж/моль
Если использовать марганцевый катализатор, то при окислении аммиака с выходом 95% образуется N2O.
4NH3 + 4O2 → 2N2О + 6H2O + 1105 кДж/моль
При использовании платинового катализатора с выходом 95% образуется окись азота NO. 4NH3 + 5O2 → 4NО + 6H2O + 986 кДж/моль
Платина обладает низкой температурой зажигания (2000С), хорошую пластичность, тягучесть. Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и каталитических ядов. Более стабильными являются модифицированные родием и палладием катализаторы. Наиболее распространены следующие катализаторы окисления аммиака:
Pt + 4%Pd +3,5%Rh (для работы при атмосферном давлении)
Pt + 7,5%Rh (для работы при повышенном давлении).
Эти катализаторы изготавливают в виде сеток из проволоки диаметром 0,09 мм, размер стороны ячейки 0,22 мм, число ячеек на 1 см длины – 32, на 1 см2 – 1024. Модифицированные платиновые катализаторы весьма чувствительны к ядам; наиболее сильными ядами являются соединения серы и фтора. Разрушают также сетки пыль и оксиды железа, попадающие в исходную смесь при синтезе аммиака; они к тому же, засоряя сетки, уменьшают поверхность катализатора. Чистоту исходных веществ в производстве азотной кислоты обеспечивают двумя путями - осуществлением дальнего забора воздуха и усовершенствованием систем очистки воздуха и аммиака.
В процессе окисления аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими. При этом поверхность сетки увеличивается примерно в 30 раз. Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток. Срок жизни катализаторных сеток: для работы под атмосферным давлением – до 14 месяцев, под давлением 0,73 МПа – 8-9 месяцев.
Каталитическое окисление NH3 – гетерогенно-каталитический процесс, протекающий во внешнедиффузионной области и лимитируемый диффузией аммиака к поверхности катализатора. Скорость окисления очень высока. За десятитысячные доли секунды степень превращения аммиака достигает 97-98% при атмосферном давлении и 95-96% под давлением 0,88-0,98 МПа. Однако выход NO может быть различным в зависимости от выбранных технологических параметров – температуры, давления, линейной скорости газа, содержания аммиака в исходной смеси, числа сеток и других факторов.
Влияние температуры. На платине окисление аммиака начинается при 1950С, однако при этом образуется молекулярный азот. Заметное количество NO начинается появляться при 3000С. При повышении температуры выход NO увеличивается. Это свидетельствует о том, что энергия активации целевой реакции выше, чем энергия активации побочной реакции. Повышение температуры также приводит к увеличению скорости процесса. Но при большой температуре увеличиваются потери дорогостоящей платины. Повышение температуры с 780 до 8500С приводит к увеличению потерь катализатора вдвое. Величина оптимальной температуры зависит от используемого в процессе давления и составляет 780-9200С.
При выборе температуры также необходимо учитывать наличие примесей в исходной смеси. Температура должна быть тем выше, чем больше примесей.
Влияние давления. С ростом давления наблюдается снижение выхода NO. Вместе с тем использование высокого давления при окислении аммиака позволяет существенно уменьшить объем газовой смеси, а следовательно – габариты оборудования, т.е. увеличить производительность реактора при сохранении его объема. Поэтому наряду с технологическими схемами, работающими при атмосферном давлении, промышленное применение нашли агрегаты, работающие при давлении 0,41 – 0.73 МПа, в которых выход окиси азота увеличивают повышением температуры и времени контактирования (увеличение числа сеток).
Влияние концентрации аммиака. Согласно уравнению реакции, для полного окисления 1 моль аммиака необходимо 1,25 моль кислорода. Исходя из этого, максимально возможное содержание аммиака в аммиачно-воздушной смеси равно 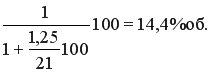
Однако при соотношении O2 : NH3 = 1,25 даже при атмосферном давлении выход NO не превышает 60-80%. Кроме того, при содержании в смеси 14.4% об. аммиака пришлось бы работать в области взрывоопасных концентраций. Нижний предел взрываемости амммиачно-воздушной смеси при атмосферном давлении составляет 13,8% об. NH3. При увеличении соотношения O2 : NH3 до 1,7, что соответствует содержанию аммиака в смеси 11,5%об. выход окиси азота увеличивается. Необходимость создания ~30% -ного избытка кислорода сверх стехиометрического связана с тем, что поверхность катализатора должна быть покрыта кислородом, в отсутствие кислорода аммиак уже при 500С начинает разлагаться на азот и водород. При дальнейшем увеличении соотношения реагентов выход целевого продукта меняется уже незначительно.
Влияние времени пребывания реагентов в реакторе. Для расчета времени контакта газов с катализатором пользуются уравнением
τ = Vсв./Vг,
где Vсв. – свободный объем катализатора, м3,
Vг – объемная скорость газа, м3/с.
Практикой показано, что оптимальное время пребывания газов в зоне катализа равно 10-4 – 10-5 с. Увеличение времени пребывания, т.е. уменьшение скорости газового потока, ведет к образованию элементарного азота. Увеличение скорости приводит к проскоку аммиака в поток нитрозного газа.
Реактор. Контактный аппарат представляет собой два усеченных конуса, соединенных между собой цилиндрической частью. В верхней части установлен фильтр с противовзрывным клапаном. Фильтр заключен в цилиндрическую обечайку, через которую подается аммиачно-воздушная смесь. Катализаторные сетки закреплены между фланцами цилиндрической части и нижнего корпуса и опираются на колосники. На решетке внизу аппарата расположен слой металлических колец, предназначенный для улавливания частиц платины и стабилизации теплового режима на катализаторных сетках.