Лекция № 6. Закономерности управления простым необратимым гетерогенным процессом
Характеристика модели:
1) Процесс простой – можно описать одним стехиометрическим уравнением
а + bВ → cС + dD, где С – целевой продукт;
β = α, так как весь реагент превращается только в целевой продукт.
2) Процесс необратимый – αmax = 100%.
Поэтому, как и в рассмотренной ранее модели простого необратимого гомогенного процесса единственным объектом управления является скорость процесса.
3) Однако процесс гетерогенный – скорость процесса не всегда равна скорости химической реакции.
Вполне очевидно, что любой химической реакции (т.е. акту разрушения одних связей и образования других) предшествует стадия диффузии, то есть движение молекул реагентов друг к другу. Эти две стадии являются последовательными, и общая скорость процесса равна скорости самой медленной стадии, которую называют лимитирующей. Лимитирующей может быть как химическая, так и диффузионная стадия.
В гомогенном процессе движение молекул реагентов осуществляется внутри одной фазы, скорость диффузии достаточно легко увеличить. Поэтому в гомогенном процессе практически всегда лимитирующей является сама химическая реакция, и скорость процесса равна скорости химической реакции. Местом протекания реакции в этом случае является весь объем реактора.
В гетерогенном процессе молекулы реагентов находятся в разных фазах или, находясь в одной фазе, они эффективно контактируют лишь на поверхности твердого катализатора. В первом случае процесс будет гетерофазным и гетерогенным, во втором – гомофазным, но гетерогенным. В гетерогенном процессе стадии химического превращения предшествует диффузионная стадия переноса молекул реагента через границу раздела фаз. Место протекания реакции локализовано, это граница раздела фаз или более плотная фаза вблизи границы раздела фаз.
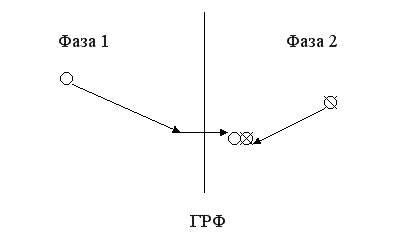
Поскольку перенос через границу раздела фаз обычно затруднен, диффузионная стадия в гетерогенном процессе очень часто является лимитирующей, то есть определяет скорость всего процесса в целом.
В зависимости от природы лимитирующей стадии различают три области протекания гетерогенного процесса: кинетическую, диффузионную и переходную. Область протекания определяет выбор инструментов управления гетерогенным процессом.
|
Область протекания процесса
|
Лимитирую-щая стадия
|
Признаки
|
Инстру-менты управления
|
Закон, лежащий в основе управления
|
|
1.Кинетичес-кая
|
химическая реакция
|
1) скорость процесса не зависит от гидродинамических параметров;
2) коэффициент Вант-Гоффа ра-вен k = 2 – 4;
3)Еа>40кДж/моль
порядок реакции обычно > 1.
|
кинетичес-кие фак-торы
(t, p, C, kat)
|
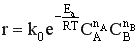
|
|
2.Диффузи-онная
|
диффузия
|
1) скорость процесса сильно зависит от гидро-динамических параметров;
2) коэффициент Вант-Гоффа ра-вен k = 1,3 – 1,7;
3)Еа<25кДж/моль
порядок реакции обычно =1.
|
гидродина-мические факторы
(скорость перемеши-вания ω, линейная скорость подачи реагента W, удельная поверхность контакта фаз f и др.)
|
r = Kм f ∆C
|
|
3. Переход-ная
|
скорость химической реакции ≈ скорости диффузии
|
при изменении параметров процесс легко переходит из диффузионной области в кинетическую и обратно.
|
кинетические и гидродинамические факторы
|
|
Один и тот же процесс в зависимости от условий проведения может протекать в разных областях. Если изобразить на графике зависимость скорости процесса от гидродинамических факторов, то та область, где скорость сильно возрастает при увеличении ω, W, f, является диффузионной. При дальнейшем увеличении этих величин зависимость становится менее выраженной – это переходная область. В кинетической области гидродинамические факторы перестают оказывать влияние на скорость процесса. Увеличение скорости в этой области требует использования кинетических факторов управления процессом (t, p, C, kat). Однако и здесь постепенно степень влияния выбранных инструментов управления снижается, процесс переходит опять в диффузионную область.
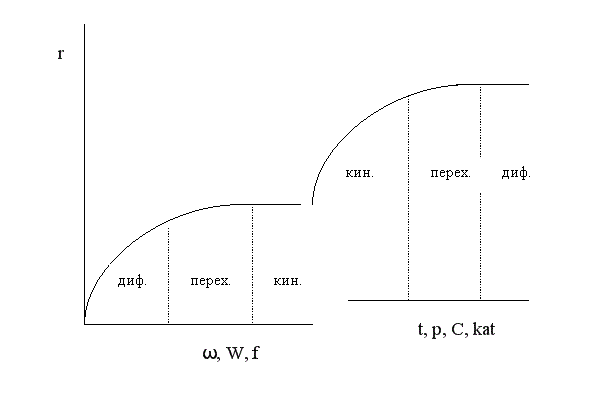
Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
Если гетерогенный процесс протекает в кинетической области, его скорость определяется скоростью химической реакции. Управлять таким процессом означает регулировать скорость химической реакции с помощью кинетических факторов (t, p, C, kat и др.). Если процесс протекает в диффузионной области, объектом управления становится скорость массопередачи; и появляются новые инструменты управления, такие как скорость перемешивания, поверхность контакта фаз и др. (гидродинамические факторы). Концентрация реагентов и температура оказывают уже меньшее влияние на процесс. Анализ влияния различных факторов на интенсивность процесса должен быть основан на законах массопередачи.
Основное уравнение массопередачи отражает зависимость скорости массопередачи от движущей силы процесса, в качестве которой выступает разность концентраций вещества в разных точках системы.
R = Kм f ∆C ,
где Км – коэффициент массопередачи, f – удельная поверхность контакта фаз, ∆C – движущая сила процесса.
Движущей силой любого массообменного процесса является разность (градиент) концентраций. Если в разных точках объема фазы концентрация вещества различна, молекулы вещества начнут самопроизвольно перемещаться в направлении, в котором концентрация его меньше.
Движущая сила процесса ∆C = С1 – С2. Скорость процесса тем больше, чем больше разность концентраций. Пределом протекания процесса является равенство концентраций во всем объеме фазы С1 = С2. В этот момент ∆C = 0 и скорость процесса массопереноса равна нулю. Таким образом, движущая сила процесса массопередачи и скорость уменьшаются во времени.
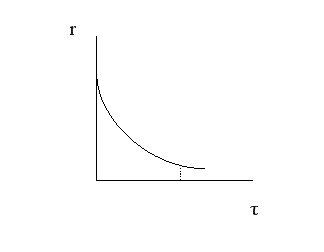
В случае гетерогенного процесса массоперенос осуществляется не только внутри фазы, но и через границу раздела фаз. Рассмотрим последовательность и предел протекания этих процессов, используя так называемую двухпленочную модель массопереноса.
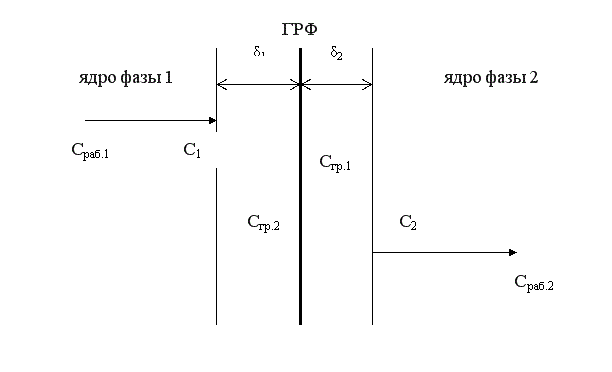
Согласно этой модели, в каждой фазе можно выделить ядро фазы, в котором перенос вещества осуществляется как молекулярной, так и конвективной диффузией, и пограничные слои толщиной δ1 и δ2, расположенные у границы раздела фаз. В этих слоях, независимо от гидродинамики внешнего потока, течение будет ламинарным, массоперенос происходит только за счет молекулярной диффузии. Очевидно, что медленной стадией является перенос вещества через пограничные слои, так как скорость молекулярной диффузии намного ниже скорости конвективной диффузии.
Пусть вещество переходит А из фазы 1 в фазу 2. Выделим основные стадии процесса.
1 стадия – перенос из ядра фазы 1 к пограничному слою этой фазы.
∆С1 = Сраб.1 – С1
При правильной организации конвективного переноса внутри фазы концентрация выравнивается очень быстро. Сраб.1 = С1.
2 стадия – перенос через пограничный слой 1 фазы (медленная стадия).
∆С2 = С1 – Сгр.1
3 стадия – перенос через границу раздела фаз.
Процесс перехода вещества через границу раздела фаз возникает самопроизвольно и протекает до тех пор, пока между фазами при данных внешних условиях (t и р) не установится подвижное фазовое равновесие, при котором скорость перехода вещества А из первой фазы во вторую будет равна скорости перехода этого вещества из фазы 2 в фазу 1. Связь между равновесными концентрациями вещества А в первой и второй фазе зависит от вида двухфазной системы. Например, для системы «г-ж» эта связь определяется законом Генри, для систем «г-т» и «ж-т» - изотермами адсорбции и т.д. В общем случае можно записать 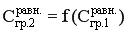 .
.
4 стадия – перенос через пограничный слой 2 фазы (медленная стадия).
∆С3 = Сгр.2 – С2
5 стадия – перенос от пограничного слоя в ядро фазы 2.
∆С4 = С2 – Сраб.2
Таким образом, мы получили систему взаимосвязанных процессов с включенной стадией подвижного равновесия.
Сраб.1 → С1 → Сгр.1 ↔ Сгр.2 → С2 → Сраб.2
Когда начинается процесс массопередачи? При организации конвективного переноса в ядре фазы 1 движущей силой процесса является разница концентраций вещества А в ядре фазы 1 и на границе раздела фаз.
∆С = Сраб.1 – Сгр.1
В момент соприкосновения фаз Сгр.1 =0, ∆С –max.
Когда процесс массопередачи закончится? Когда Сраб.1 станет равной Сгр.1. Это равенство может быть достигнуто только при установлении динамического равновесия, когда Сгр.1 и Сгр.2 достигают своих равновесных значений и не изменяются во времени. А это, в свою очередь, возможно, когда Сраб.2 = С2, а С2 = Сгр.2.
То есть, в конечном счете, величина движущей силы процесса массопередачи равна разности между рабочей и равновесной концентрацией переходящего вещества в передающей фазе.
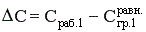
Как можно увеличить движущую силу, а, следовательно, и скорость процесса?
-
повысить рабочую концентрацию вещества (реагента), то есть работать с более концентрированным сырьем;
-
понизить равновесную концентрацию вещества на границе раздела фаз.
Для этого нужно, изменяя внешние условия, сместить равновесие вправо. Выбор способа смещения равновесия зависит от конкретного типа равновесной системы. Например, для системы «г-ж» сместить равновесие процесса растворения газа в жидкости можно, увеличивая давление и уменьшая температуру. Для систем «г-т» и «ж-т» необходимо найти условия смещения равновесия процесса адсорбции. Обычно для этого тоже понижают температуру и повышают давление. Для систем «ж-ж», а также «т-ж» (когда твердое вещество растворяется в жидкости) обычно повышают температуру. Принципы смещения равновесия в процессах массопереноса те же, что для химических равновесий. Если процесс протекает с выделением тепла (растворение газа в жидкости, адсорбция) смещать равновесие вправо будет понижение температуры; в случае эндотермического процесса (растворение жидкости и твердого тела) – повышение температуры.
В химических гетерогенных процессах мощным фактором, смещающим фазовое равновесие, является химическая реакция. Если скорость химической реакции намного больше скорости массопередачи (то есть процесс протекает в диффузионной области), движущая сила процесса равна разнице между рабочей концентрацией вещества в передающей фазе и концентрацией его в зоне реакции.
∆С = Сраб.1 – Сз.р.,
так как фазовое равновесие практически не устанавливается до тех пор, пока осуществляется химическая реакция. В этом случае скорость процесса можно увеличить только путем повышения Сраб.1.
Если скорость химической реакции намного меньше скорости массопередачи (процесс протекает в кинетической области), скорость можно увеличить, используя кинетические факторы. Скорость процесса в этом случае, как правило, и так высока.
В переходной области, при соизмеримых скоростях процесса массопередачи и химической реакции, изменяя технологические параметры, следует ожидать, что это окажет влияние и на скорость химической реакции, и на состояние фазового равновесия. Например,
А(т) ↔ А(раств.)
А(раств.) + В → С
Повышение температуры в этом случае приводит к повышению константы скорости химической реакции и к увеличению концентрации растворенного вещества А в результате смещения фазового равновесия. Скорость процесса однозначно будет возрастать.
А(г) ↔ А(раств.)
А(раств.) + В → С
Во втором случае повышение температуры увеличит константу скорости химической реакции, но уменьшит концентрацию растворенного вещества А. Предсказать, как изменится скорость процесса, трудно.
Другим инструментом управления гетерогенным процессом, протекающим в диффузионной области, является коэффициент массопередачи Км. Коэффициент массопередачи характеризует количество вещества, переданного из фазы в фазу через единицу поверхности в единицу времени при движущей силе, равной единице. Коэффициент массопередачи тем выше, чем больше коэффициент молекулярной диффузии диффундирующего вещества в данной фазе, чем интенсивнее организована конвективная диффузия и чем меньше толщина пограничного слоя δ. Для повышения коэффициента конвективной диффузии и уменьшения толщины пограничного слоя используют различные методы турбулизации внешнего потока (ядра фазы): повышение скорости движения потока, интенсификацию перемешивания, вибрацию поверхности или увеличение ее шероховатости в случае систем «ж - т» или «г – т», импульсный ввод энергии, воздействие электрических и магнитных полей и др.
Наиболее эффективным способом интенсификации гетерогенных процессов, протекающих в диффузионной области, является увеличение поверхности раздела фаз. В основное уравнение массопередачи входит не действительная поверхность контакта фаз, а условная величина, называемая удельной поверхностью контакта фаз и имеющая размерность м2/м3.
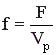
где F – поверхность контакта фаз, Vр – рабочий объем реактора.
Чем больше f, тем больше скорость массопередачи. Для увеличения удельной поверхности контакта фаз одну из фаз (наиболее плотную) измельчают и распределяют в объеме другой фазы.
В случае систем «г - т» и «ж – т» измельчают твердую фазу и распределяют ее в объеме газа или жидкости, то есть работают с взвешенными твердыми частицами или с суспензиями. В системе «ж – ж» одна жидкость диспергируется в другой, получают эмульсии. Для систем «г – ж» применяют два режима:
- барботажный – диспергирование газа в жидкости;
- скрубберный – диспергирование жидкости в газе.
От способа создания поверхности контакта фаз зависит конструкция реактора.
Не следует стремиться к максимально возможной величине межфазной поверхности. Она должна быть оптимальной, так как слишком сильное диспергирование одной из фаз приводит, обычно к уносу ее из аппарата и другим нежелательным эффектам. Например, пылевидное состояние твердой фазы увеличивает ее гидравлическое сопротивление и приводит к значительным потерям в результате уноса при больших скоростях потока газа или жидкости; чрезмерное увеличение кратности вспенивания при организации пенного режима снижает эффективность использования объема реактора и т.д.
Следует отметить, что наличие высокоразвитой поверхности не гарантирует высокой скорости процесса. Эта поверхность должна обладать работоспособностью. Накопление продуктов реакции на поверхности контакта фаз часто является причиной уменьшения скорости процесса, а иногда и полного его ингибирования, то есть лимитирующей стадией может стать стадия диффузионного отвода продуктов реакции с поверхности. В таком случае для поддержания работоспособности поверхности на протяжении всего процесса необходима организация ее постоянного обновления.
Процессы массопередачи в гомогенных средах
Вполне очевидно, что в гомогенном процессе химической стадии тоже предшествует стадия диффузии, причем молекулы реагентов должны равномерно распределиться по всему объему реактора. В жидкофазных процессах диффузию интенсифицируют, используя различные способы перемешивания. Различают два вида смешения, обеспечивающие различную степень гомогенизации среды.
Состояние жидкости, при котором молекулы совершенно свободно перемещаются по объему реактора, называется несегрегированным. При таком перемешивании происходит равномерное распределение веществ по объему реактора; скорость перемешивания и другие гидродинамические факторы не оказывают влияния на скорость процесса.
В сегрегированном состоянии жидкость представляет собой совокупность большого числа глобул, каждая из которых содержит порядка 1012 молекул. Считают, что внешняя оболочка глобулы химически инертна, ее единственное назначение – сохранение глобулы. Сегрегированное состояние жидкости способствует возникновению локальных высоких концентраций реагентов, особенно в местах их подачи.
Реальные жидкофазные системы чаще всего являются сегрегированными. Сегрегация нарушает нормальное распределение реагентов и может влиять на селективность сложных реакций. Например,
А + В → С (целевой продукт)
С + B → D
Если молекула целевого продукта окажется в одной глобуле с молекулами реагента А, селективность будет высокая, если с молекулами реагента В – низкая.
Пример: Технология получения серной кислоты. Получение обжигового газа из колчедана.
В основе процесса лежит следующая реакция:
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
Фактически она протекает через несколько последовательно-параллельных стадий: сначала происходит медленная эндотермическая реакция термического разложения FeS2
2FeS2 → 2 FeS + S2,
а затем начинаются сильно экзотермические реакции горения паров серы
S2 + 2О2 → SO2
и окисления сульфида железа FeS
4FeS + 7О2 → 4SO2 +2Fe2O3.
Конечными продуктами горения колчедана являются обжиговый газ, содержащий SO2 , и твердый огарок, состоящий из несгоревших соединений и Fe2O3.
Технологическая классификация процесса: необратимый, гетерогенный, сильно экзотермический процесс. Поскольку все реакции ведут к образованию целевого продукта, можно условно считать этот процесс простым.
Объект управления – скорость процесса.
Обжиг колчедана – типичный гетерогенный процесс в системе «г – т», в котором химической стадии предшествуют медленные диффузионные стадии. Для увеличения скорости процесса стремятся, прежде всего, уменьшить сопротивление диффузионных стадий, то есть работать в кинетической области. Это достигается измельчением твердой фазы и интенсивной турбулизацией потока. Наиболее удобным аппаратом для этой цели является печь с псевдоожиженным слоем колчедана ( печь «кипящего слоя» КС). На рисунке изображена печь КС. Она представляет собой шахту, стальной корпус которой футерован огнеупорным материалом.
В нижней части печи расположена решетка с большим числом отверстий, через которые подаваемый снизу воздух равномерно распределяется по всему сечению печи. В зоне кипящего слоя помещены охлаждающие элементы (стальные трубы), присоединенные к системе принудительной циркуляции парового котла-утилизатора. Огарок через провальную решетку в бункер, однако большая часть огарка (до 90%) уносится с обжиговым газом.
Для обжига колчедана используют и другие печи, в которых по-иному решен вопрос о характере движения твердой фазы: механические (подовые), печи пылевидного обжига, циклонные печи и др. Печи КС характеризуются максимальной интенсивностью по сравнению с другими конструкциями. В псевдоожиженном слое обеспечивается высокая скорость диффузионных и теплообменных процессов (подвод кислорода к поверхности колчедана, отвод диоксида серы в газовый поток, отвод теплоты от поверхности сырья к газовому потоку). Отсутствие тормозящего влияния массо- и теплообмена позволяет проводить обжиг колчедана в таких печах с высокой скоростью. К недостаткам печей КС можно отнести высокую запыленность обжигового газа.
Температура процесса обжига колчедана поддерживается в интервале 600 – 7000С в зависимости от состава сырья. При более низких температурах мала скорость процесса; при t < 5000С не может протекать эндотермическая реакция разложения дисульфида железа. Слишком высокие температуры вызывают нежелательный физический процесс спекания частиц горящего материала, приводящий к увеличению их размеров. Следствием этого является увеличение времени горения и понижение производительности печи. Поскольку процесс обжига колчедана является экзотермическим, для поддержания необходимой температуры проводится отвод тепла.
Колчедан, применяемый для обжига, предварительно обогащают флотацией. Флотационный колчедан содержит ряд примесей (соединения мышьяка, селена, теллура, фтора), которые при обжиге переходят в состав обжигового газа в виде оксидов. Наличие этих примесей обусловливает необходимость последующей очистки газа.
Воздух берется обычно в избытке к стехиометрическому количеству. Чем больше коэффициент избытка, тем меньше концентрация диоксида серы в обжиговом газе.